[ZD12] Incidenca levkemije pri otrocih

Ključno sporočilo

Levkemija je najpogostejši rak v otroštvu. Predstavlja 25 do 30 % vseh na novo odkritih rakavih bolezni pri otrocih, mlajših od 15 let. Vzročni mehanizmi za nastanek levkemije pri otrocih so slabo poznani, vendar se pogosto omenja povezava z okoljskimi dejavniki tveganja. Podatki evropskih registrov raka kažejo, da je incidenčna stopnja levkemij pri otrocih med leti 1970 in 1999 rasla povprečno za 0.7 % letno, opazne so razlike med vzhodnimi in zahodnimi evropskimi državami. V Sloveniji zaradi majhnega števila primerov ne moremo opisati značilnega trenda v obdobju 1998-2008.
Definicija
Kazalec prikazuje incidenco levkemije pri otrocih starih 0-14 let v Sloveniji in nekaterih evropskih državah.
Levkemija je najpogostejša rakava bolezen otrok. Predstavlja 25 do 30% vseh na novo odkritih rakavih bolezni pri otrocih mlajših od 15 let (WHO, 2007). Kakor pri vseh rakavih obolenjih v otroški dobi, ostajajo tudi pri levkemijah vzroki za nastanek bolezni v 90 % primerov neznani. Nekateri okoljski dejavniki tveganja, kot so ionizirno in neionizirno sevanje ter kemikalije v okolju, so po dosedanjih podatkih prispevali k nastanku le zelo malega števila primerov bolezni. Kljub temu je epidemiološko spremljanje levkemij v otroški dobi pomembno, saj je razumevanje mehanizmov učinkovanja okoljskih dejavnikov na živa tkiva še precej nepopolno, je pa že dokazano pojavljanje bolezni v skupkih – klustrih, kar povečuje možnost infektivnega ali okoljskega dejavnika.
Osnovna kazalnika, ki merita pogostnost bolezni v določenem času, prostoru ali pri določenih populacijah, sta incidenca in prevalenca.
Incidenca pomeni število vseh na novo ugotovljenih primerov neke bolezni v točno določeni populaciji v enem koledarskem letu in je zato osnovni kazalec dinamike pojava (naraščanje, upadanje, nespremenljivost). Incidenco lahko izražamo z absolutnim številom, večinoma pa v obliki stopnje, preračunano na določeno število prebivalstva. Groba incidenčna stopnja je podatek o številu novih primerov bolezni, preračunana na 100.000 oseb opazovane populacije.
Kadar želimo primerjati več populacij med seboj, moramo upoštevati, da je starostna struktura populacij lahko zelo različna, kar lahko močno vpliva na vrednost incidence. V teh primerih uporabljamo starostno standardizacijo. Starostno standardizirana stopnja je teoretična stopnja, pri kateri predpostavimo, da je starostna struktura opazovane populacije taka kot v standardni populaciji – pove nam torej kakšna bi bila groba stopnja incidence v opazovani populaciji, če bi bila starostna struktura te populacije enaka kot je v standardni populaciji. Uporabljamo jo, če analiziramo incidenco v daljšem časovnem obdobju (če se starostna struktura prebivalstva v času spreminja) ali če incidenco primerjamo med populacijami z različno starostno strukturo.
Na povečanje incidence opazovane bolezni vplivajo predvsem naslednji dejavniki:
- povečana koncentracija dejavnika za razvoj bolezni,
- večja dovzetnost ljudi za bolezen,
- izboljšanje diagnostičnih možnosti in s tem omogočanje bolj učinkovitega odkrivanja bolezni ter izboljšanje kvalitete zbiranja podatkov,
- priseljevanje za bolezen dovzetnih ljudi.
Prevalenca je število vseh bolnikov z določeno boleznijo, ki so bili živi na izbrani datum (ponavadi zadnji dan v letu). Izraža stanje opazovanega pojava v populaciji. Na povečanje prevalence opazovane bolezni vplivajo predvsem incidenca in trajanje bolezni (odvisno od značilnosti bolezni in od kvalitete zdravstvene oskrbe), ozdravljivost, umrljivost in selivnost.
Grafi
Zadnik, Primic Žakelj, Epidemiologija in register raka, Onkološki inštitut Ljubljana, 2011.
| 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| incidenca | število novih primerov | 13 | 13 | 14 | 14 | 12 | 9 | 12 | 9 | 12 | 15 |
| 2008 | |||||||||||
| incidenca | število novih primerov | 13 |
WHO, 2007.
| Romunija | Portugalska | Poljska | Češka | Slovenija | Madžarska | Slovaška | Litva | Bolgarija | Estonija | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| SSS | SSS/milijon preb | 31.3 | 32.2 | 32.3 | 36.8 | 37.1 | 37.9 | 37.9 | 38.2 | 39.6 | 40 |
| standardizirano povprečje | SSS/milijon preb | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 |
| Nizozemska | Združeno kraljestvo | Španija | Irska | Francija | Švedska | Nemčija | Malta | Danska | Švica | ||
| SSS | SSS/milijon preb | 40.7 | 41 | 41.1 | 41.2 | 41.3 | 41.7 | 44.8 | 45 | 47.3 | 48.3 |
| standardizirano povprečje | SSS/milijon preb | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 | 42.4 |
| Finska | Italija | ||||||||||
| SSS | SSS/milijon preb | 50.8 | 53.9 | ||||||||
| standardizirano povprečje | SSS/milijon preb | 42.4 | 42.4 |
Cilji
- koordinirane raziskave vpliva okoljskih dejavnikov na levkemijo ter okoljsko-genetskih interakcij; nujno je epidemiološko spremljanje levkemije pri otrocih z natančnim pridobivanjem podatkov o izpostavljenosti otrok in staršev okoljskim dejavnikom tveganja,
- postopno nadomeščanje rakotvornih, mutagenih in strupenih snovi z varnejšimi snovmi, ki nimajo vplivov na zdravje ljudi,
- zaščititi bolnike pred pretiranimi sevanji za medicinske namene,
- nosečnicam in otrokom v zgodnjem otroštvu zagotoviti, da ne bodo izpostavljeni ionizirnim sevanjem oz. da ta ostanejo minimalna.
Komentar
Levkemija je najpogostejša rakava bolezen otroške dobe. V Evropi sta pri otrocih med 0-14 let najbolj pogosti akutna limfoblastna levkemija (ALL), ki predstavlja okoli 80% vseh levkemij pri otrocih, ter akutna mieloična levkemija (AML), ki predstavlja okoli 20 % vseh levkemij pri otrocih (Coebergh, 2006).
V večini primerov levkemije pri otrocih vzrok ni znan. Ugotovljeni so sicer številni vzroki in zelo verjetni dejavniki tveganja, vendar strokovnjaki poudarjajo, da so le-ti odgovorni le za zelo majhno število primerov. Znani in zelo verjetni vzroki za razvoj levkemije pri otrocih so genetski dejavniki (2-3% vseh primerov, povezanih z Downovim sindromom) in izpostavljenosti ionizirnim sevanjem v maternici in po rojstvu (Stiller, 2004; Belson, 2007). Nalezljive bolezni bi lahko bile vzročni dejavnik za nastanek levkemije pri otrocih, še posebej pri ALL (akutna limfoblastna levkemija) (Belson, 2007; O’Connor, 2007). Tudi zakasnjena izpostavljenost okužbi v zgodnjem obdobju novorojenčka lahko povzroči nenormalen imunski odziv, ki vodi do razvoja levkemije (Ravindranath, 2003).
Letna incidenca je za ALL (akutna limfoblastna levkemija ) do 40 primerov na milijon otrok v industrializiranih državah zahodne Evrope ter do 30-35 primerov na milijon otrok v vzhodnoevropskih državah, vendar manj kot 20 na milijon v podsaharski Afriki (Parkin, 1998). Letna incidenca za AML (akutna mieloična levkemija) je precej stabilna, kar pomeni 5-9 primerov na milijon otrok na leto (Coebergh, 2006; Parkin, 1998). Podatki evropskih registrov raka kažejo, da je incidenčna stopnja levkemij pri otrocih med leti 1970 in 1999 rasla povprečno 0.7% letno (WHO, 2007).
Na osnovi podatkov Registra raka Republike Slovenije o številu za levkemijo zbolelih otrok (0-14 let) v obdobju 1998 do 2008 ne moremo sklepati na značilnost podatkovnega niza. Število novih primerov se je sicer v istem obdobju gibalo med 9 do 15, vendar velja ob tem opozoriti, da gre za zelo majhno število primerov, zaradi česar moramo biti pri interpretaciji podatkov previdni. Vsak primer pomeni namreč relativno veliko spremembo v skupnem številu primerov.
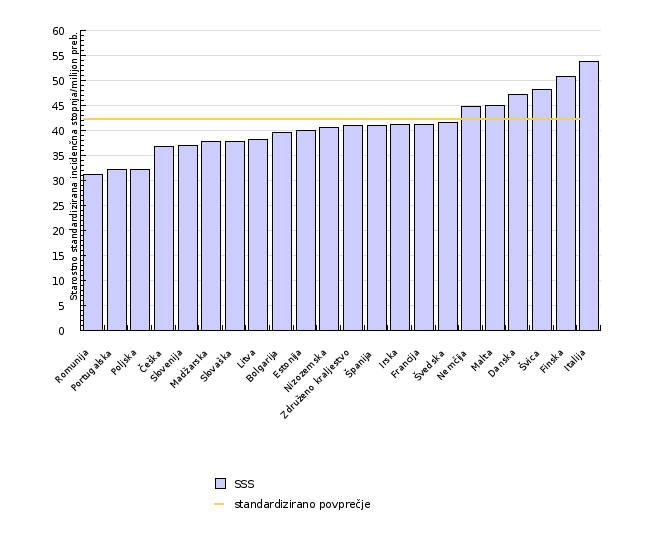
Po podatkih ENHIS, kjer je podana primerjava med evropskimi državami za pojavnost levkemij pri otrocih, starosti 0-14 let, standardizirana na svetovni standard, je bilo skupno število levkemij v Sloveniji v letih 1970 – 1999 nekoliko nižje od povprečja držav evropske regije (WHO, 2007). Največja pojavnost levkemije je bila leta 2000 zabeležena v državah Italija, Finska, Švica, Danska, medtem ko je bila najnižja v Romuniji, Portugalski, Poljski, Češki in Sloveniji. Kot je bilo značilno že za pretekla leta (WHO, 2007), so tudi v letu 2000 vidne razlike med vzhodnimi in zahodnimi evropskimi državami, z nižjimi povprečnimi vrednostmi na vzhodu in višjimi na zahodu. Za opažene razlike med vzhodno in zahodno evropskimi državami je lahko vzrok korelacija med socialno-ekonomskim razvojem in pojavnostjo ALL (akutna limfoblastna levkemija).
Mednarodna iniciativa za spodbujanje raziskav o morebitnih dejavnikih tveganja za levkemijo v Evropi je pomanjkljiva, zato tudi ni specifičnih politik, usmerjenih neposredno na zmanjšanje pojavnosti levkemije. Pomembna na tem področju je vsekakor uredba Evropskega parlamenta in Sveta o Registraciji, evalvaciji, avtorizaciji in omejevanju uporabe kemikalij (REACH) (REACH, 2006). Cilj REACH je postopno nadomestiti industrijske snovi, za katere je znano, da so rakotvorne, mutagene ali strupene za razmnoževanje. Prav tako pomembna je Direktiva Sveta 97/43/Euratom (Council Directive 97/43/Euratom, 1997), ki si prizadeva zaščititi bolnike pred pretiranim izpostavljanjem sevanju v medicinske namene in zagotoviti minimalno izpostavljenost v času nosečnosti in v zgodnjem otroštvu.
Glede na slabo poznavanje vzročnih mehanizmov za levkemijo pri otrocih, je politike za zmanjšanje pojavnosti težko oblikovati in imajo omejen vpliv. Na primer, politike za zmanjševanje izpostavljenosti ionizirnim ali elektromagnetnim sevanjem lahko preprečijo le majhen delež primerov levkemije. Torej je potrebno nadaljnje usklajeno raziskovanje vplivov okoljskih dejavnikov tveganja na levkemijo in okoljsko-genetske interakcije. Še posebej pomembno je natančno epidemiološko spremljanje levkemij pri otrocih. Nacionalni registri s stalnim spremljanjem, ki bi uporabljali standardizirane ali primerljive metode, bi morali biti univerzalni za vse države članice EU.
Zelo pomembno pa je tudi zdravljenje levkemij. Večina levkemij pri otrocih se danes uspešno zdravi. Tako je sredi 1990-ih let petletno preživetje doseglo 82% za ALL (akutna limfoblastna levkemija) in 53% za AML (akutna mieloična levkemija) (Coebergh, 2006). Nadaljnje skupne raziskave in izmenjava znanja med evropskimi državami bi lahko povečale odstotek preživelih otrok med zbolelimi za levkemijo. Z vidika javnega zdravja je umrljivost za levkemijo pomemben so-kazalec kakovosti sistema zdravstvenega varstva, vendar ga je treba razlagati previdno zaradi težnje za višje preživetje v državah, ki imajo tudi višjo incidenco.
Metodologija
Podatki za Slovenijo:
Cilji so povzeti po: Uredbi (ES) št. 1907/2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) ter Direktivi sveta 97/43/EURATOM o varstvu zdravja posameznikov pred nevarnostjo ionizirajočega sevanja zaradi izpostavljenosti sevanju v zdravstvu.
Izvorna baza podatkov oz. vir: Register raka Republike Slovenije, Portal SLORA.
Skrbnik podatkov: Onkološki inštitut Ljubljana.
Datum zajema podatkov za kazalec: 01. 12. 2011
Metodologija in frekvenca zbiranja podatkov za kazalec: Podatki so predstavljeni za obdobje 1998-2008. Podatki se zbirajo na letni ravni. Podatki o incidenci raka se zbirajo po Zakonu o zdravstveni dejavnosti (Ur.l.RS št. 9/92) ter po Zakonu o zbirkah podatkov s področja zdravstvenega varstva (UR.l.RS št. 65/00). Za izračun kazalca so bili uporabljeni uradni podatki o številu prijavljenih primerov levkemij, ki so zajeti v Registru raka Republike Slovenije, ki je eden najstarejših populacijskih registrov v Evropi. Ustanovljen je bil leta 1950 na Onkološkem inštitutu Ljubljana kot posebna služba za zbiranje in obdelavo podatkov o vseh novih primerih raka (incidenci) in o preživetju bolnikov z rakom.
Podatke o številu zbolelih za rakom v Sloveniji Register raka RS redno pošilja bankam podatkov Svetovne zdravstvene organizacije in drugih mednarodnih organizacij. Register raka sproti preverja in obnavlja podatke v svoji bazi, zato se lahko izpisi, pripravljeni s programom SLORA, nekoliko, a ne za več kot nekaj primerov letno, razlikujejo od števila zbolelih iz mednarodnih baz podatkov.
Metodologija obdelave podatkov: Podatki o številu otrok starosti 0-14 let zbolelih za levkemijo so podani kot število zbolelih v absolutnem številu.
Informacije o kakovosti:
- Prednosti in slabosti kazalca: Za izračun kazalca so uporabljeni uradno poročani podatki, prosto dostopni javnosti. Za primerljivost z drugimi državami je uporabljena starostno standardizirana (na svetovno populacijo) incidenčna stopnja.
- Relevantnost, točnost, robustnost, negotovost:
Zanesljivost kazalca (arhivski podatki): Podatki so zelo zanesljivi.
Negotovost kazalca (scenariji/projekcije): Projekcije in scenariji niso na voljo.
- Skupna ocena (1 = brez večjih pripomb, 3 = podatki z zadržkom):
Relevantnost: 1
Točnost: 1
Časovna primerljivost: 1
Prostorska primerljivost: 1
Podatki za druge države:
Izvorna baza podatkov oz. vir: Projekt ENHIS (The European Environment and Health Information System) - Incidence of childhood leukaemia. Podatki o levkemijah pri otrocih so bili zajeti iz projekta ACCIS (Automated Childhood Cancer Information System) (IARC, 2006), ki ga podpira Evropska Komisija.
Skrbnik podatkov: Svetovna zdravstvena organizacija (World Health Organization - WHO).
Datum zajema podatkov za kazalec: 17. 9. 2010
Metodologija in frekvenca zbiranja podatkov za kazalec: Glavni vir podatkov je Cancer incidence in five continents, Vol. IX (CI5-IX) (Curado, 2007), v katerem so zbrani podatki nacionalnih populacijskih registrov raka, ki zajemajo podatke za osebe vseh starosti. V nekaterih državah, kjer populacija ni v celoti pokrita v CI5-IX, so bili podatki dopolnjeni ali zamenjani s podatki specializiranih registrov raka za otroke (Kaatsch, 2004; Petridou, 2008; Török, 2005; Michel, 2008). Registri raka, iz katerih so pridobljeni podatki, se posodabljajo sproti, večina njih objavlja letna poročila.
Metodologija obdelave podatkov: Podatki o številu zbolelih otrok za levkemijo so podani kot število zbolelih, standardizirano na svetovno standardno populacijo starosti 0-14 let; podano je tudi število novih primerov na milijon prebivalcev na leto.
Informacije o kakovosti:
- Prednosti in slabosti kazalca: Trenutno ni podatkov po letu 1999 za mednarodne primerjave. V večini evropskih registrov so podatki na voljo od začetka leta 1980.
- Relevantnost, točnost, robustnost, negotovost :
Zanesljivost kazalca (arhivski podatki): Podatki so zanesljivi.
Negotovost kazalca (scenariji/projekcije): Scenariji in projekcije niso na voljo.
- Skupna ocena (1 = brez večjih pripomb, 3 = podatki z zadržkom):
Relevantnost: 1
Točnost: 1
Časovna primerljivost: 1
Prostorska primerljivost: 1
Drugi viri in literatura:
- Belson M., Kingsley B., Holme A., 2007. Risk factors for acute leukemia in children: a review. Environmental Health Perspectives, 115:138–145.
- Coebergh J.W., Reedijk A.M., de Vries E., Martos C., Jakab Z., Steliarova-Foucher E., Kamps W.A., 2006. Leukaemia incidence and survival in children and adolescents in Europe during 1978–1997. Report from the Automated Childhood Cancer Information System project. European Journal of Cancer, 42:2019–2036.
- Committee on Medical Aspects of Radiation in the Environment (COMARE), 2006. Eleventh report. The distribution of childhood leukaemia and other childhood cancers in Great Britain 1969–1993. London, Health Protection Agency.
- Council Directive 97/43/Euratom of 30 June 1997 on health protection of individuals against the dangers of ionizing radiation in relation to medical exposure, and repealing Directive 84/466/Euratom. Official Journal of the European Union, 1997, L180:22–27.
- Curado M.P., Edwards B., Shin H.R., Storm H., Ferlay J., Heanue M., and Boyle P. (ur.), 2007. Cancer incidence in five continents, Vol. IX (CI5-IX). Lyon, International Agency for Research on Cancer. IARC Scientific Publications No. 160.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, 2002. Non-ionizing radiation Part 1: static and extremely low-frequency (ELF) electric and magnetic fields. Lyon, International Agency for Research on Cancer. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 80.
- IARC, 2006: CANCERMondial. Automated Childhood Cancer Information System (ACCIS) [database]. Lyons, International Agency for Research on Cancer.
- Infante-Rivard C., Weichenthal S., 2007. Pesticides and childhood cancer: an update of Zahm and Ward’s 1998 review. Journal of Toxicology and Environmental Health, Part B, 10:81–99.
- Jazbec J., Rajić V., Karas-Kuželički N., 2008. Levkemije otroške dobe. Zdravniški Vestnik, 77:I25-30.
- Kaatsch P., Spix C., 2004. German Childhood Cancer Registry. Annual Report 2003 (1980–2002). Mainz, Deutsches Kinderkrebsregister.
- Ma X., Buffler P.A., Gunier R.B., Dahl G., Smith M.T., Reinier K., Reynolds P., 2002. Critical windows of exposure to household pesticides and risk of childhood leukaemia. Environmental Health Perspectives, 110:955–960.
- Michel G., von der Veid N.X., Zwahlen M., Redmond S., Strippoli M.P.F., Kuehni C.E., 2008. Incidence of childhood cancer in Switzerland: the Swiss Childhood Cancer Registry. Pediatric Blood and Cancer, 50:46–51.
- O’Connor S.M., Boneva R.S., 2007. Infectious etiologies of childhood leukemia: plausibility and challenges to proof. Environmental Health Perspectives, 115:146–150.
- Parkin D.M., Kramarova E., Draper G.J. (ur.), 1998. International incidence of childhood cancer, Vol. II. Lyon, International Agency for Research on Cancer, (IARC Scientific Publications No. 144).
- Poole C., Greenland S., Luetters C., Kelsey J.L., Mezei G, 2006. Socioeconomic status and childhood leukaemia: a review. International Journal of Epidemiology, 35:370–384.
- Petridou E.T., Pourtsidis A., Dessypris N., Katsiardanis K., Baka M., Moschovi M., Polychronopoulou S., Koliouskas D., Sidi V., Athanasiadou-Piperopoulou F., Kalmanti M., Belechri M., La Vecchia C., Curado M.P., Skalkidis I., 2008. Childhood leukaemias and lymphomas in Greece (1996–2006): a nationwide registration study. Archives of Disease in Childhood, 93:1027–1032.
- Register Raka RS, 2010: Rak v Sloveniji 2007. Ljubljana, Onkološki inštitut Ljubljana.
- Ravindranath Y., 2003. Recent advances in pediatric acute lymphoblastic leukema. Curr Opin Oncol, 15: 23–35.
- Registration, Evaluation and Authorisation of Chemicals (REACH). Official Journal of the European Union, 2006, L396:1–849.
- Rudant J., Menegaux F., Leverger G., Baruchel A., Nelken B., Bertrand Y., Patte C., Pacquement H., Vérité C., Robert A., Michel G., Margueritte G., Gandemer v., Hémon D., Clavel J., 2007. Household exposure to pesticides and risk of childhood hematopoietic malignancies: the ESCALE study (SFCE). Environmental Health Perspectives 115:1787–1793.
- Stiller C.A., 2004. Epidemiology and genetics of childhood cancer. Oncogene, 23:6429–6444.
- Török S. Borgulya G., Lobmayer P., Jakab Z., Schuller D., Fekete G., 2005. Childhood leukaemia incidence in Hungary, 1973–2002. Interpolation model for analyzing the possible effects of the Chernobyl accident. European Journal of Epidemiology, 20:899–906.
- UK Childhood Cancer Study Investigators, 2000. Childhood cancer and proximity to power lines. Br J Cancer, 83: 1573–80.
- Urayama K.Y., Wiencke J. K., Buffler P. A., Chokkalingam A. P., Metayer C., Wiemels J. L., 2007. MDR1 gene variants, indoor insecticide exposure, and the risk of childhood acute lymphoblastic leukemia. Cancer Epidemiology Biomarkers and Prevention, 16:1172–1177.
- WHO, 2004: Hazardous chemicals: main risk to children’s health. Fact sheet EURO/02/04. Copenhagen, World Health Organisation.
- WHO, 2007: Incidence of childhood leukaemia, ENHIS fact sheet No. 4.1. Copenhagen, World Health Organisation.
- WHO, 2009: Incidence of childhood leukaemia, ENHIS fact sheet No. 4.1. Copenhagen, World Health Organisation.
- Zadnik V., Primic Žakelj M., 2010. SLORA: Slovenija in rak. Epidemiologija in register raka. Onkološki inštitut Ljubljana.
- Zahm S.H., Ward M.H., 1998. Pesticides and childhood cancer. Environmental Health Perspectives, 106(Suppl. 3):893–908.